医薬品「緊急承認制度」新設へ
✍️記事要約
感染症の世界的大流行の際などに、医薬品の迅速な実用化を可能とする「緊急承認制度」の創設を柱とした改正医薬品医療機器法(薬機法)が13日の参院本会議で全会一致で可決、成立した。政府は近く政令を改正し、新型コロナウイルス感染症の医薬品を緊急承認制度の対象に指定する。開発中の国産の治療薬やワクチンへの適用の可否が今後の焦点となる。
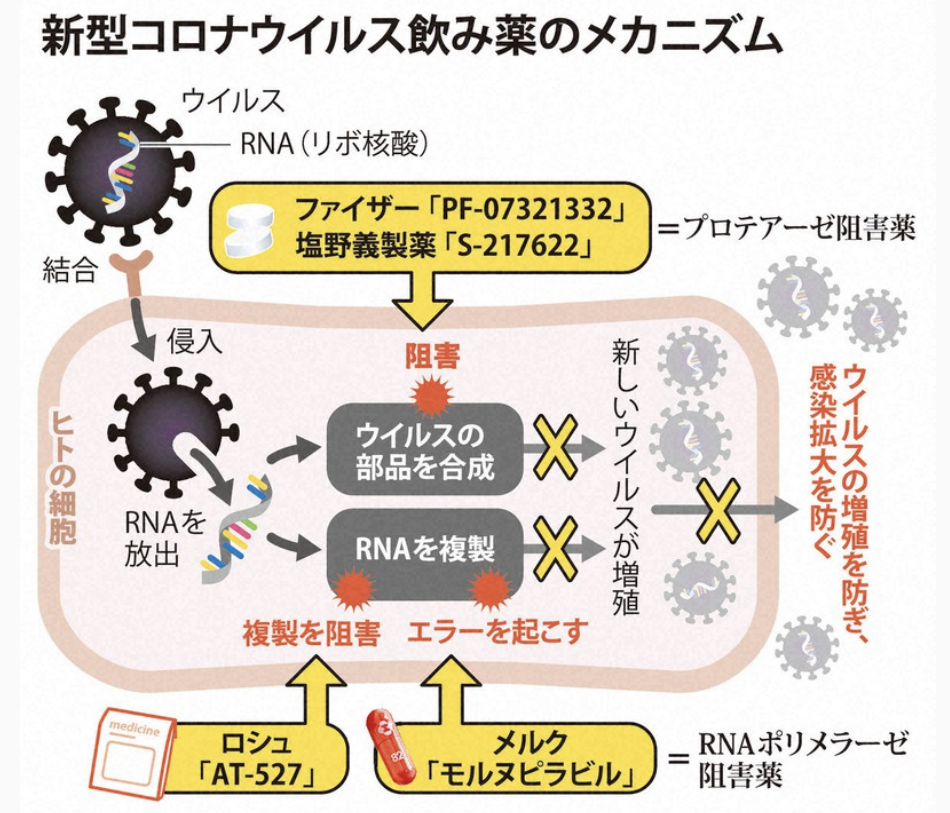
緊急承認制度は、安全性は従来通り確認するが、有効性については治験の途中段階でのデータから「推定」できれば承認を可能とする。これまでは原則として大規模治験で有効性を確認後に承認してきたが、新たな制度では治験完了前の早期実用化が可能となる。
従来は、海外で使用実績がある医薬品については「特例承認」で審査を簡略化してきたが、日本人を対象とした国内治験を追加で求めたため、新型コロナワクチンの実用化が欧米より遅れた。新制度では、国内治験が未実施でも海外データから有効性を「推定」し、実用化できるようになる。
新制度の適用は、感染症の流行のほか、原発事故やテロなど国民の生命に重大な影響を与える緊急時や、他に代替手段がない場合に限る。最長2年の期限内に有効性の確認を求め、確認できない場合は承認を取り消す。健康被害が起きた場合は、通常の承認薬と同様、医薬品副作用被害救済制度の対象とし、医療費や障害年金が支払われる。
新型コロナへの対応では、海外製ワクチンの実用化の遅れや、国産医薬品を対象とする緊急時の薬事制度の不備などが問題となった。足元では塩野義製薬が軽症者向け治療薬の薬事承認を申請しており、新制度創設による審査への影響が注視される。
◇ ◇ ◇
☘️ヤフコメ❗️ピックアップ☘️
これまでの「特例承認」制度は、外国の様子を見てから国内対応を検討するという点で、ある意味主体性の無い制度。今回の「緊急承認」制度は、我が国の主体的な脅威認識に従って承認するという点では進歩。
しかし、そもそも米国などの緊急承認制度(EUA)にはほど遠い。EUAは緊急時のみに発動されるのではなく、平時でも「潜在的な危機」に対して発動し、以下の2つの目的に使われる。
①脅威が発現する前に備蓄しておく目的
②市場性がない危機管理医薬品に対してEUAというステップ/インセンティブを開発の中途段階で与えて企業の参入を促す目的(市場の失敗を克服して企業の参入を容易にする目的)
本日国会で成立した「緊急承認」制度はここがまだ欠けているため、更なる発展が望まれる。
✅ 今後も、新薬や新治療法を速やかに承認する事は非常に重要になってくると思われるが、当然ながら一方で、慎重に慎重を期す、やり過ぎくらいに慎重を期すという、これまでの安全最優先方針を若干であれ下げることになる。
これは致し方の無い部分であり、その妥協点は、疑いも含めての、副作用副反応による被害者への補償がセットにならないといけないだろう。精神的な反応まで含めれば、永久に因果関係が解明されない可能性もあるが、それもまた副作用の一つだと考えないといけない。
何かあれば国が補償する、という前提でなければ、結果的には被害者が泣き寝入りするしかない。危険を承知で処方を受けたのだろう?という話になってしまう。
問題が発生した場合、原因解明を待たずに、まず国が責任を持って補償にあたる、という事を単純明快に示せばかなり物事はスムーズに運ぶ。
責任の所在の明確化と補償問題に尽きると思う。
✅ 本来この制度は、国民の『生命に重大な危機』となる疾病の蔓延や事件の発生時に、『他の手段がない場合』の緊急承認、を想定していた制度です。
現在適用が考えられているのは、「既に普及している海外開発品と同程度の性能と推定される国内開発品があれば、症状への有効性を確認する前に承認する」というもの。
つまり海外先行品が完了している大規模の第三相試験を、国内品は後回しにして承認する制度ということになります。
国内企業は助かりますし、制度成立は議員にとっても大きなアピールとなります。
選択肢や国産品を求める国民にとっては喜ばしい一方、本当に今の状況が上記の緊急事態に該当しているのかを含め、科学的には懸念も残ると思います。
![]()
